お知らせ一覧
| 2025/6/23 | 令和7年5月21日開催 第2回 治験審査委員会の「会議の記録の概要」を公開しました。 |
|---|---|
| 2025/6/20 | 令和7年6月18日開催 第3回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2025/6/1 | 2025年6月1日付で臨床検査基準値を変更しました。 |
| 2025/5/30 | 申請手続き 「1 新規治験 手続要領」、「2 変更申請の手続き」、「3 大阪国際がんセンター施設基本情報」を更新しました。 |
| 2025/5/28 | 令和7年4月23日開催 第1回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2025/5/23 | 令和7年5月21日開催 第2回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2025/4/30 | 令和7年3月19日開催 第12回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2025/4/25 | 令和7年4月23日開催 第1回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2025/3/28 | 令和7年2月19日開催 第11回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2025/3/24 | 令和7年3月19日開催 第12回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2025/3/5 | 2025年2月26日付で臨床検査基準値を変更しました。 |
| 2025/2/25 | 令和7年1月22日開催 第10回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2025/2/21 | 令和7年2月19日開催 第11回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2025/1/27 | 令和6年12月18日開催 第9回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2025/1/24 | 令和7年1月22日開催 第10回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/12/27 | 令和6年11月20日開催 第8回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/12/20 | 令和6年12月18日開催 第9回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/11/27 | 令和6年10月17日開催 第7回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/11/22 | 令和6年11月20日開催 第8回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/10/23 | 令和6年9月18日開催 第6回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/10/18 | 令和6年10月16日開催 第7回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/9/25 | 令和6年8月21日開催 第5回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/9/19 | 令和6年9月18日開催 第6回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/8/28 | 令和6年7月17日開催 第4回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/8/22 | 令和6年8月21日開催 第5回 治験審査委員会 本審査 / 迅速審査の治験審査結果通知書(書式5)を発行しました。 |
| 2024/7/24 | 令和6年6月19日開催 第3回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/7/3 | 令和6年5月22日開催 第2回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/5/27 | 令和6年4月17日開催 第1回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/4/18 | 「治験審査委員会委員名簿(令和6年度4月)」を掲載致しました。 |
| 2024/4/18 | 「治験薬管理業務手順書」(2024/04/01 改定)を掲載致しました。 |
| 2024/4/18 | 令和6年3月27日開催 第12回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/3/29 | 令和6年2月21日開催 第11回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/2/22 | 令和6年1月24日開催 第10回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/1/25 | 令和5年12月20日開催 第9回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2024/1/25 | 「2024年度 治験審査委員会開催日程(令和6年度(2024年度))」を掲載致しました。 |
| 2023/12/22 | 令和5年11月15日開催 第8回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/11/16 | 令和5年10月18日開催 第7回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/10/19 | 令和5年9月20日開催 第6回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/9/21 | 令和5年8月16日開催 第5回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/8/17 | 令和5年7月19日開催 第4回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/7/20 | 令和5年6月21日開催 第3回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/6/22 | 令和5年5月24日開催 第2回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 2023/5/25 | 令和5年4月19日開催 第1回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 23/5/15 | 臨床検査基準値を変更しました。 「臨床研究推進室からのお知らせ」 |
| 23/4/20 | 令和5年3月15日開催 第12回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 23/3/16 | 令和5年2月15日開催 第11回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 23/2/16 | 令和5年1月18日開催 第10回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 23/2/10 | 「2023年度 治験審査委員会開催日程 (令和5年度(2023年度))」を掲載致しました。 |
| 23/1/19 | 令和4年12月21日開催 第9回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/12/22 | 令和4年11月16日開催 第8回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/11/17 | 令和4年10月19日開催 第7回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/10/20 | 令和4年9月21日開催 第6回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/9/22 | 令和4年8月17日開催 第5回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/8/18 | 令和4年7月20日開催 第4回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/7/21 | 令和4年6月15日開催 第3回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/6/16 | 令和4年5月25日開催 第2回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/5/26 | 令和4年4月20日開催 第1回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/4/21 | 令和4年3月16日開催 第12回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/3/17 | 令和4年2月16日開催 第11回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/2/17 | 令和4年1月26日開催 第10回 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/1/27 | 令和3年12月22日開催 第9回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 22/1/27 | <治験審査委員会に関するお知らせ> |
| 21/12/23 | 令和3年11月17日開催 第8回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/12/23 | <お知らせ> 継続審査について 当センターでは毎年2月IRBで継続審査の一括審議を行っています。 これに伴う下記の書類を2022年1月31日までに事務局担当者宛にご提出ください。 2月IRB以前に書式11をご提出いただいた場合でも、2月IRBへ提出くださいますようお願いいたします。 【提出書類】 ①統一書式<書式11> ※別添の記載要綱参照のこと。 ②(大)書式6 ※製販後は(大)書式7 *平成25年10月~令和3年(2021年)9月IRBで初回審議された試験については、 審査費用が発生いたします。 [平成25年10月~令和2年3月]のIRBで承認された治験の(大)書式6は 書式の下段≪今回納入すべき費用≫の「継続審査」欄に〇を入れて提出ください。 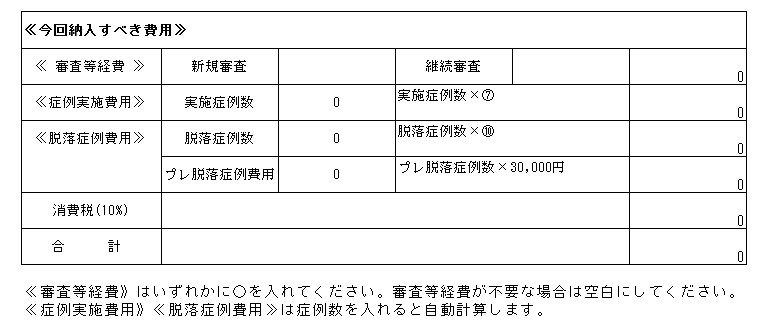 [令和2年4月以降]のIRBで承認された新規治験の(大)書式6は 書式の下段≪提出時モニター入力欄≫の「審査区分」で「継続」を選択して提出ください。 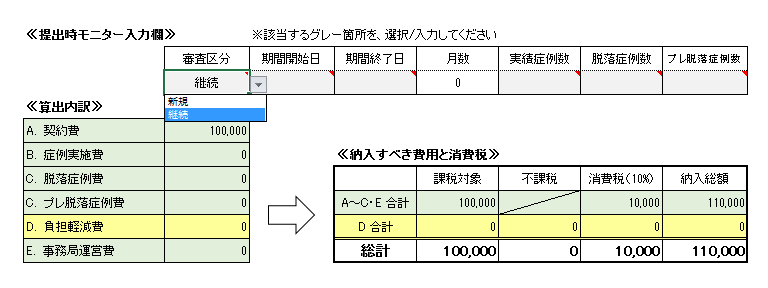 継続審査 書式11.記載要綱(pdf) |
| 21/11/18 | 令和3年10月20日開催 第7回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/10/21 | 令和3年09月22日開催 第6回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/09/24 | 令和3年08月18日開催 第5回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/08/23 | 令和3年07月21日開催 第4回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/07/26 | 令和3年06月16日開催 第3回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/06/21 | 令和3年05月26日開催 第2回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/06/01 | 令和3年04月21日開催 第1回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/04/23 | 令和3年03月17日開催 第12回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/03/24 | 2021年度(令和3年度)の治験審査委員会の開催日程を公開しました。 |
| 21/03/18 | 令和3年02月17日開催 第11回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/02/18 | ・令和2年12月16日開催 第9回治験審査委員会の「会議の記録の概要」を公開しました。 ・令和3年01月20日開催 第10回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 21/01/04 | <継続審査について> 当センターでは毎年2月IRBで継続審査の一括審議を行っています。 これに伴う下記の書類を2020年1月31日までに事務局担当者宛にご提出ください。 2月IRB以前に書式11をご提出いただいた場合でも、2月IRBへ提出くださいますよう お願いいたします。 【提出書類】 ①統一書式<書式11> ②(大)書式6 ※製販後は(大)書式7 *平成25年10月~令和2年(2020年)9月IRBで初回審議された試験については、 審査費用が発生いたします。 [平成25年10月~令和2年3月]のIRBで承認された治験の(大)書式6は 書式の下段≪今回納入すべき費用≫の「継続審査」欄に〇を入れて提出ください。  [令和2年4月以降]のIRBで承認された新規治験の(大)書式6は [令和2年4月以降]のIRBで承認された新規治験の(大)書式6は書式の下段≪提出時モニター入力欄≫の「審査区分」で「継続」を選択して提出ください。 
|
| 20/12/18 | 下記に明らかな誤記があったため修正いたしました。 ●大阪国際がんセンター治験審査委員会標準業務手順書改訂令和2年5月19日(治験審査委員会の運営) 第5条第4項 誤:(1) 治験審査委員会は、以下の要件を満たす会議においてのみ、その意思を決定できるものとする。委員の過半数以上の出席でかつ、少なくとも5人以上の委員からなること。ただし、過半数の基準となる委員の総数としては第6項に該当する委員は含めないものとする。正:(1) 治験審査委員会は、以下の要件を満たす会議においてのみ、その意思を決定できるものとする。委員の過半数以上の出席でかつ、少なくとも5人以上の委員からなること。ただし、過半数の基準となる委員の総数としては第7項に該当する委員は含めないものとする。 |
| 20/12/17 | 令和2年11月18日開催 第8回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/11/19 | 令和2年10月21日開催 第7回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/10/21 | 令和2年9月16日開催 第6回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/9/17 | 令和2年8月19日開催 第5回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/8/20 | 令和2年7月15日開催 第4回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/7/16 | 令和2年6月17日開催 第3回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/6/18 | 令和2年5月27日開催 第2回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/5/28 | 令和2年4月15日開催 第1回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/04/16 | 令和2年3月18日開催 第12回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/04/01 | 組織名変更に伴い、下記のSOP等を改訂いたしました。 (旧組織名)治験推進管理室 (新組織名)研究管理室 令和2年4月1日改訂 ■大阪国際がんセンター治験標準業務手順書 ■大阪国際がんセンター治験審査委員会設置要綱 ■大阪国際がんセンター医師主導治験標準業務手順書 ■大阪国際がんセンター医師主導治験取扱規程 |
| 20/03/19 | <治験・臨床研究費改定のお知らせ> 当センターでは、現行の治験・研究経費に係るポイント表、算定明細、契約書を見直し、改定を進めてまいりました。次年度(令和2年4月IRB審議)の新規治験より改定後のセンター書式を、ご使用いただくことになります。 現在実施中の治験と令和2年4月以降承認の新規治験とで、使用するセンター書式の掲載をわけています。 詳しくは「統一書式・センター書式」 でご確認ください。 |
| 20/03/19 | 令和2年2月19日開催 第11回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/2/20 | 令和2年1月22日開催 第10回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/1/23 | 令和元年12月18日開催 第9回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 20/1/15 | <お知らせ>継続審査について 当センターでは毎年2月IRBで継続審査の一括審議を行っています。 これに伴う下記の書類を2020年1月31日までに事務局担当者宛にご提出ください。 2月IRB以前に書式11をご提出いただいた場合でも、2月IRBへ提出くださいますよう お願いいたします。 【提出書類】 ①書式11 ②(大)書式6 ※製販後は(大)書式7 *平成25年10月~令和1年(2019年)9月IRBで初回審議された試験については、 審査費用が発生いたします。 書式の下段≪今回納入すべき費用≫の「継続審査」欄に〇を入れて提出ください。 
|
| 19/12/25 | 令和元年11月27日開催 第8回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/11/28 | 令和元年10月16日開催 第7回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/10/25 | 令和元年9月18日開催 第6回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/9/30 | 消費税法改正に伴う治験費用の対応についてのお知らせ |
| 19/9/20 | 治験審査委員の役職を修正しましたので下記を更新しました。 「治験審査委員会 委員名簿」(令和1年度9月) |
| 19/9/20 | 令和元年8月21日開催 第5回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/9/2 | 治験審査委員が更新されましたので「治験審査委員会 名簿」に公開しました。 |
| 19/8/26 | 令和元年7月17日開催 第4回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/7/22 | 令和元年6月19日開催 第3回治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/6/27 | 令和元年5月22日開催 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/5/23 | 平成31年4月17日開催 治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/4/18 | 平成31年3月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/4/9 | 平成31年4月1日付で治験審査委員会委員名簿を変更しました。 |
| 19/4/1 | ・組織名変更に伴い、下記のSOP等と改訂いたしました。 (旧組織名)臨床研究センター 治験臨床研究管理室 (新組織名)治験推進管理室平成31年4月1日改訂 ■大阪国際がんセンター治験標準業務手順書 ■大阪国際がんセンター治験進化委員会設置要綱 ■大阪国際がんセンター医師主導治験標準業務手順書 ■大阪国際がんセンター医師主導治験取扱規程 |
| 19/3/22 | 平成31年2月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/2/21 | 平成31年1月23日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/1/24 | 平成30年12月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 19/1/18 | <お知らせ>受託研究の四半期請求について ●平成31年2月1日までに、平成30年10月~12月の受託研究実施状況報告書((受)書式8-2) のご提出をお願いいたします。 ・実施症例がない場合は「無し」でご連絡お願い致します。 ・平成30年10月以前の実施状況報告行われていない場合は、平成30年10月~12月分に追加 して、ご提出お願いいたします。 【提出書類】 (受)書式8-2 受託研究実施状況報告書 【提出〆切】 平成31年2月1日(金) |
| 19/1/8 | <お知らせ>継続審査について 当センターでは毎年2月IRBで継続審査の一括審議を行っています。 これに伴う下記の書類を2019年1月31日までに事務局担当者宛にご提出ください。 2月IRB以前に書式11をご提出いただいた場合でも、2月IRBへ提出くださいますよう お願いいたします。 【提出書類】 ①書式11 ②(大)書式6 ※製販後は(大)書式7 *平成25年10月~平成30年9月IRBで初回審議された試験については、審査費用が発生いた します。 書式の下段≪今回納入すべき費用≫の「継続審査」欄に〇を入れて提出ください。 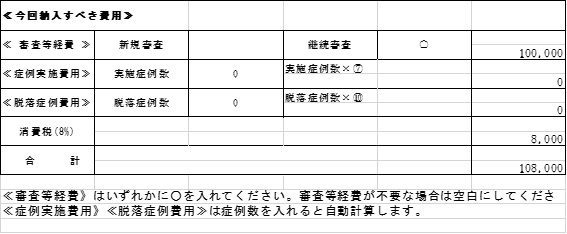
|
| 18/12/20 | 平成30年11月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/11/22 | 平成30年10月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/10/23 | 平成30年9月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/9/20 | 平成30年8月22日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/8/27 | 平成30年7月10日に発出されました「新たな『治験の依頼等に係る統一書式』」の一部改正について( 医政研発0710第4号・薬生薬審発0710第2号・薬生機審発0710第2号)に伴い、以下の手順書等を改訂いたしました。 内容につきましては、各手順書をご確認ください。 ・治験標準業務手順書(平成30年8月27日改訂) ・治験審査委員会標準業務手順書(平成30年8月27日改訂) ・電磁的記録による治験手続標準業務手順書(平成30年8月27日改訂) ・治験審査委員会の運営について(迅速審査規程) ・大阪国際がんセンター医師主導治験標準業務手順書 ・医師主導治験における治験審査委員会標準業務手順書 カット・ドゥ・スクエアには、8月27日より、新統一書式が掲載されておりますので、使用いただくようお願いいたします。 |
| 18/8/22 | 平成30年7月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/7/20 | ●統一書式(平成30年7月10日発出)の使用について
当センターでは、カット・ドゥ・スクエアを使用しているため、カット.ドゥ・スクエアの カット・ドゥ・スクエアでは、2018年8月27日に「統一書式の改訂」および「規制当局へ 詳細が決まりましたら、ホームページでお知らせいたしますので、現時点での新統一書式 |
| 18/7/19 | 平成30年6月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/7/18 | 平成30年5月23日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/6/12 | 平成30年4月25日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/5/2 | 平成30年3月14日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/4/3 | 「治験に関する規程」に治験契約書の目標症例数記載削除の手続きについて掲載いたしました。 |
| 18/4/1 | <お知らせ>四半期請求について ● 平成30年4月10日までに、平成30年1月から3月の実施症例及び脱落症例にかかる研究費算定明細書を提出してください。 【提出書類】 ● 臨床試験研究経費算定明細書((大)書式6) →≪今回納入すべき費用≫に実施症例数(投与と脱落)を入力したもの ※製造販売後臨床試験の場合は、該当書式を提出 ※平成27年度7月以降締結分については、(大)書式6-2もご提出をお願いします。 |
| 18/3/19 | ・平成28年2月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ・「電磁的記録の収受に関する治験手続標準手順書」を掲載しました。2018年4月1日施行分を掲載しております。 ・治験審査委員会の運営について ・治験契約書 ・製造販売後臨床試験契約書 ・目標とする契約症例数に関する合意文書 ・(大)書式6-2 ・(大)書式7-2 |
| 18/3/5 | ●平成30年1月24日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 18/1/25 | ●平成29年12月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●治験審査委員会の開催日程(平成30年度)を掲載しました。 |
| 18/1/18 | ●「医師主導治験標準業務手順書」「医師主導における治験審査委員会標準業務手順書」を改訂いたしました。 |
| 18/1/5 | <お知らせ>継続審査について 当センターでは毎年2月に継続審査の一括審議を行っています。 これに伴う下記の書類を2018年1月31日までに川上宛にご提出ください。 【提出書類】 ①書式11 ②(大)書式6 ※製販後は(大)書式7 *平成25年10月~平成29年9月IRBで初回審議された試験については、審査費用が発生いたします 書式の下段≪今回納入すべき費用≫の「継続審査」欄に〇を入れて提出ください 。 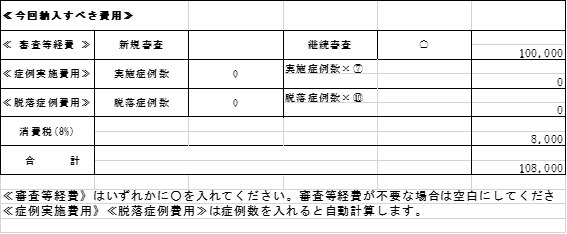
|
| 17/12/28 | ●平成29年11月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 <お知らせ>四半期請求【平成30年1月期】の症例実施費用の実績請求について平成29年10月~12月末までの3ヶ月間で投与開始またはスクリーニング脱落があった症例において、1月12日までに下記の提出をお願いします。
提出書類
|
| 17/12/13 | ●治験標準業務手順書を改訂いたしました。 |
| 17/11/17 | ●平成29年10月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●「大阪国際がんセンター治験審査委員会設置要綱」の誤記修正いたしました。 《別表》治験審査委員会委員構成表 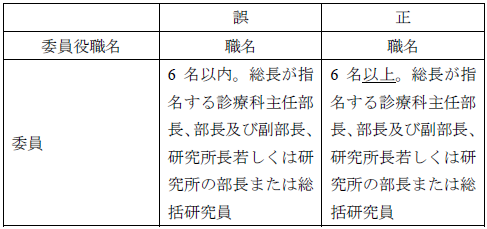
|
| 17/10/23 | ● 平成29年9月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ● 「治験審査委員会の運営について」誤記修正いたしました。 |
| 17/10/2 |
|
| 17/9/29 | ● 平成29年8月16日開催の治験審査委員会の「会議の記録の概要」を公開しました 。 ● 電磁的記録による治験手続標準業務手順書を更新しました。 |
| 17/8/21 | ●治験審査結果通知書についてのお知らせ |
| 17/8/20 | ● 平成29年7月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 17/8/1 | ● 「治験及び製造販売後臨床試験に係る研究経費算出基準」および(大)書式10を更新いたしました。 |
| 17/7/27 | ● 平成29年6月21日開催の治験審査委員会の「会議の記録の概要」を公開しました 。 |
| 17/6/10 | ● 平成29年5月24日開催の治験審査委員会の「会議の記録の概要」を公開しました 。 ● 治験審査委員会委員名簿を更新しました。 |
| 17/5/29 | ● 平成29年4月12日開催の治験審査委員会の「会議の記録の概要」を公開しました 。 |
| 17/5/15 | 4月IRB 書式5の委員出欠リスト「職業、資格及び所属」欄の一部を本お知らせをもちまして読み替え対応として頂けますでしょうか。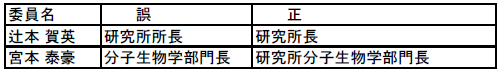
|
| 17/5/12 | ● 平成29年4月の迅速審査結果はCtDoSに登録致しました。 |
| 17/3/1 | ● 平成29年2月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 17/2/10 | <お知らせ> ● 治験標準業務手順書を改訂いたしました。 |
| 17/1/24 |
|
| 17/1/12 |
|
| 16/12/27 |
|
| 16/12/26 | ●平成28年11月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ● 「治験記録の長期保存についての取り扱い要領」改訂版を更新いたしました。掲載が遅くなり申し訳ございません。 |
| 16/12/1 | ●センター書式 (成)書式6-2を更新しました。 |
| 16/11/24 | ●平成28年10月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/11/14 | ●治験審査委員会標準業務手順書(平成28年9月29日改訂)を更新しました。 |
| 16/10/11 | ●治験標準業務手順書(平成27年9月29日改訂)を更新しました。 ●治験標準業務手順書新旧対照表(平成28年9月29日改訂)を更新しました。 ●治験審査委員会標準業務手順書(平成28年9 月29日改訂)を更新しました。 |
| 16/9/5 | ●平成28年7月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/7/22 | ●平成28年6月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/6/22 |
|
| 16/6/16 | ●平成28年5月25日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/5/31 | ●平成28年4月27日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/5/25 | ●「治験審査委員会設置要綱」を更新しました。 ●「大阪府立成人病センター 施設基本情報」を更新いたしました。 |
| 16/4/11 | ●「平成28年度治験審査委員会名簿(平成28年度4月)」を更新しました。 ●「治験審査委員会の開催日程(平成28年度)」に誤記がありましたので修正いたしました。 |
| 16/4/1 | ●【SOP・規程集】→【治験標準業務手順書 補遺】に下記の項目を更新しました。 電磁的記録による治験手続標準業務手順書 ●【受託研究・製造販売後調査】で下記の項目を更新しました。 受託研究取扱規程 (受)書式1受託研究契約書(製造販売後調査用) (受)書式8受託研究経費算出表 (受)書式8-2_受託研究実施状況報告書 |
| 16/3/23 | ●平成28年2月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/3/8 | ●治験審査委員会の開催日程(平成28年度)を掲載いたしました。 |
| 16/2/25 | ●平カット・ドゥ・スクエアで2月IRB 新規、変更案件およびSAEの「審査結果通知書(書式5)」の作成および登録が終了いたしました。ご確認ください。 |
| 16/2/23 | ●カット・ドゥ・スクエアで「1月IRB審査結果通知書(書式5)」の作成および登録が終了いたしました。ご確認ください。 |
| 16/2/18 | ●平成28年1月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 16/1/25 | ●平成27年12 月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/12/25 | ●平成27年11月IRB審議の「審査結果通知書」を作成いたしましたのでカット・ドゥ・スクエアでご確認ください。 |
| 15/12/22 | ●2015年11月19日付の治験審査結果通知書について
●平成27年11月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 <お知らせ>四半期請求のお知らせ <お知らせ>継続審査について |
| 15/12/1 | ●カット・ドゥ・スクエアでの平成27年10月IRB「審査結果通知書」の作成が完了いたしましたのでご確認ください。 |
| 15/11/19 | ●平成27年10月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/11/5 | ●統一書式・センター書式 (成)書式6-2を更新いたしました。 |
| 15/11/4 | ●11月1日付け人事異動のため院内CRCに変更がありました。詳細は事務局までご連絡ください。 |
| 15/10/29 | ●平成27年9月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●下記の書式を更新しました。 受託研究に関する書式 (受)書式1受託研究契約書(製造販売後調査用) (受)書式2受託研究契約書(その他受託研究用) |
| 15/9/24 | ●平成27年8月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●平治験標準業務手順書を改正いたしました。(平成27年9月18日付) |
| 15/8/24 | ●平成27年7月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/7/24 |
|
| 15/7/21 | ●平成27年6月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/6/29 | ●平成27年5月27日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/5/29 | ●平成27年4月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●患者さまへのページ、「治験参加者募集」を更新しました。 |
| 15/5/11 | ●同意・説明文書を更新いたしました。(ホームページのアドレスを変更しました) |
| 15/4/13 | ●「施設基本情報」、「治験審査委員会委員名簿」を更新しました。 |
| 15/3/26 | ●平成27年2月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/2/26 | ●平成27年1 月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●平成27年度治験審査委員会開催日程をアップいたしました |
| 15/1/23 | ●平成26年12 月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 15/1/19 |
|
| 14/12/18 | ●平成26年11月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/12/15 | ●「電子カルテ閲覧に伴うID申請について」を掲載いたしました。 ●継続審査は2月IRBで実施いたします。 ●薬事法改正に伴う名称変更について、契約書等は読み替え対応とさせていただきます。 ●治験審査委員会設置要綱を更新いたしました。 |
| 14/11/21 | ●平成26年10月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/10/31 | ●【費用の請求(四半期請求)について】を掲載いたしました。 |
| 14/10/20 | ●平成26年9月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/09/24 | ●平成26年8月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/08/21 | ●平成26年7月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/07/24 |
|
| 14/07/18 | ●平成26年6月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/06/25 | ●平成26年5月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●(成)書式6 臨床試験研究費算定明細書(治験)を更新しました。 ⇒長期保存欄を追加しました。 |
| 14/06/13 |
|
| 14/05/29 | ●治験標準業務手順書 補遺を掲載しました。 ●治験標準業務手順書を更新しています。 ●平成26年4月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/05/13 | ●大阪府立成人病センター 治験審査委員会設置要綱を更新しました。 ●治験審査委員会委員名簿を更新しました。 ●「患者さまへ」のページの「参加募集中の治験一覧」を平成26年5月1日現在に更新しました。 |
| 14/04/17 | ●平成26年3月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 14/04/07 | ●平成26年2月19日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●人事異動により治験審査委員会委員名簿を更新しました。 ●大阪府立成人病センター施設基本情報を更新しました。 |
| 14/03/14 | ●消費税8%に対応する治験及び受託研究のセンター書式を更新しました。 契約書、覚書の一部文言が変更されています。 受託研究の自動計算機能をなくしました。 |
| 14/03/06 | ●平成25年1月22日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●消費税8%に対応するセンター書式を掲載しました。 ●「患者さまへ」のページの「参加募集中の治験一覧」を平成26年2月28日現在に更新しました。 |
| 14/01/24 | ●「患者さまへ」のページの「参加募集中の治験一覧」を平成26年1月10日現在に更新しました。 ●平成25年12月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/12/20 | ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年12月1日現在に更新しました。 ●平成25年11月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/11/27 | ●ゲノム・遺伝子解析研究申請書を改訂しました。平成25年12月1日から施行します。なお、既に作成、提出された研究申請書については旧書式も有効です。 ●平成25年10月16日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/11/15 | ●平成25年9月18日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年11月1日現在に更新しました。 ●治験手続要領を改訂しました。 |
| 13/10/01 | ●治験費用算出基準を改訂しています。 ●平成25年8月21日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年10月1日現在に更新しました。 |
| 13/09/10 | ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年9月1日現在に更新しました。 ●平成25年7月171日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●成人病センター書式の改訂版について、誤記、一部PDF化の不良等がありましたので、差し替えて、再度、掲載いたしました。 |
| 13/08/16 |
|
| 13/07/05 | ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年7月1日現在に更新しました。 ●平成25年5月15日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/06/11 | ●「患者さまへ」のページの「参加募集中の治験一覧」を平成25年6月7日現在に更新しました。 ●平成25年4月17日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/05/07 | ●企業治験および医師主導治験、受託研究、製造販売後調査の統一書式を改正し、記名、押印欄を廃止しました。 2013年4月の治験審査委員会および受託研究審査委員会分から適用いたします。なお、記名、押印した申請書類についても、受付、審査いたしますが、当センターから送付する書類には記名押印いたしません。 ●平成25年3月13日開催の治験審査委員会の「会議の記録の概要」を公開しました。 |
| 13/04/18 | ●「患者さまへ」のページの「参加募集中の治験一覧」を更新しています。 ●平成25年2月20日開催の治験審査委員会の「会議の記録の概要」を公開しました。 ●人事異動により治験審査委員名簿を更新しました。 ●施設基本情報を更新しています。 |
| 13/04/02 | ●統一書式を平成25年3月26日付けの新たな「治験の依頼等に係る統一書式」に改訂いたしました。 |











